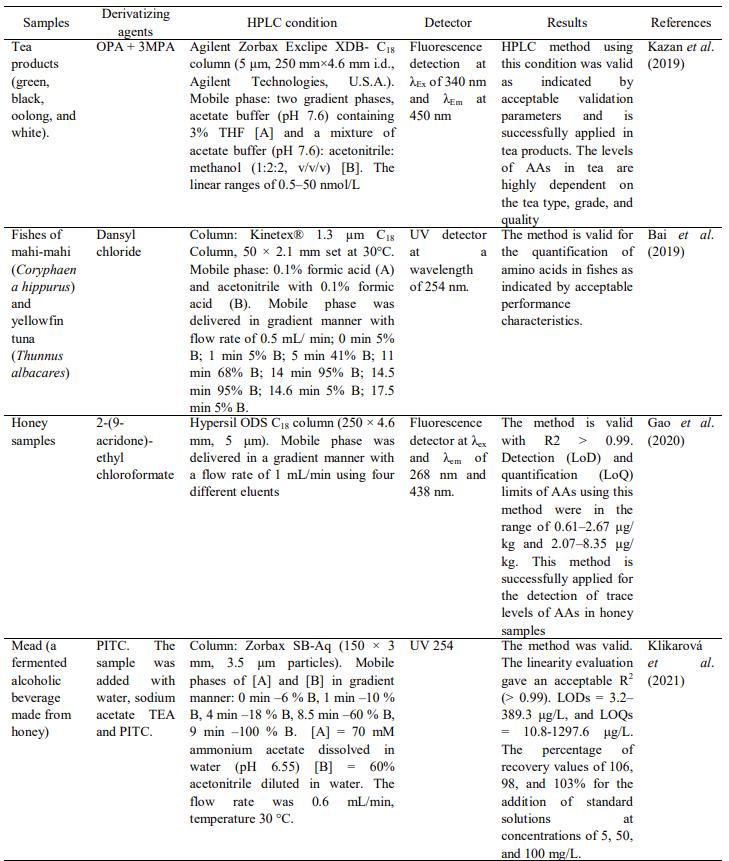
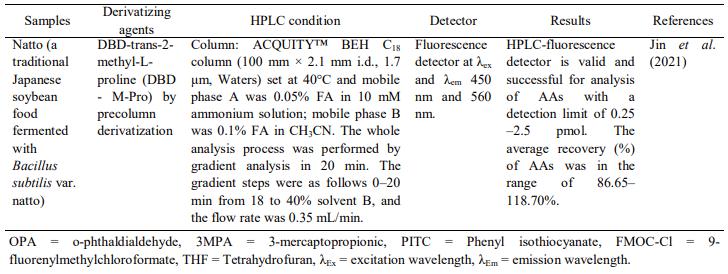
Tổng quan: Phân tích axit amin (Amino Acid) trong thực phẩm bằng Sắc ký lỏng hiệu năng cao với các kỹ thuật dẫn xuất
Phân tích acid amin trong thực phẩm bằng Sắc ký lỏng hiệu năng cao với các kỹ thuật dẫn xuất
Tóm tắt
Axit amin (AA) là thành phần thiết yếu cần thiết cho sức khỏe con người. AA thường có dạng tự do hoặc liên kết trong xương sống protein. Việc xác định AA rất quan trọng để đánh giá giá trị dinh dưỡng của thực phẩm chứa protein và để xác thực các sản phẩm thực phẩm khỏi bất kỳ hành vi pha trộn nào. Do khả năng cung cấp khả năng phân tách, các phương pháp dựa trên sắc ký được coi là phương pháp lựa chọn để phân tích AA. Các đầu dò phổ biến được sử dụng để phân tích các thành phần thực phẩm là các đầu dò cụ thể bao gồm UV-Vis và huỳnh quang. Thật không may, hầu hết AA là hợp chất không tạo màu hoặc huỳnh quang, do đó, một số quy trình dẫn xuất là cần thiết bằng cách sử dụng các tác nhân dẫn xuất để làm cho AA có thể phát hiện được bằng đầu dò UV-Vis hoặc huỳnh quang. Tổng quan này nêu bật việc sử dụng HPLC để phân tích AA trong các sản phẩm thực phẩm bằng cách áp dụng các kỹ thuật dẫn xuất trước cột và sau cột để có thể phát hiện được bằng đầu dò UV-Vis hoặc huỳnh quang
Giới thiệu
Axit amin (Amino Acid) (AA) là nhóm hợp chất hữu cơ, dẫn xuất của hydrocarbon, chứa nhóm amin bậc một (-NH2) hoặc amin bậc hai (-NH) và nhóm cacboxyl (-COOH) cùng với chuỗi bên thay đổi, như thể hiện trong Hình 1. Mặc dù được gọi là axit, AA là lưỡng tính do các nhóm chức năng có thể cho hoặc nhận proton. Trong một số điều kiện nhất định, chẳng hạn như ở độ pH sinh lý, AA có khả năng trở thành ion lưỡng tính. AA có thể được phân loại thành các phân nhóm theo các tiêu chí khác nhau, cụ thể là độ phân cực, độ quang học, chức năng sinh học và vị trí của nhóm amin trong chuỗi bên (Violi và cộng sự, 2020).
Phân tích AA có thể được tìm thấy trong nhiều lĩnh vực nghiên cứu và mục đích quan trọng nhất là đánh giá giá trị dinh dưỡng của các sản phẩm thực phẩm và đồ uống (Callejón và cộng sự, 2010). Gần đây, hồ sơ của AA được sử dụng để đánh giá một số bệnh bao gồm ung thư phổi bằng cách phân biệt giữa mô ung thư và mô bình thường lân cận (Lu và cộng sự, 2021) hoặc bằng cách nghiên cứu các dấu ấn sinh học axit amin để phát hiện nhiễm trùng huyết (Ahn và cộng sự, 2021). Thành phần của AA trong một số loại thực phẩm có thể được sử dụng như một công cụ để phát hiện sự pha trộn
Hồ sơ axit amin kết hợp với phương pháp hóa học đã được áp dụng thành công để xác thực nước cam (Wistaff và cộng sự, 2021).
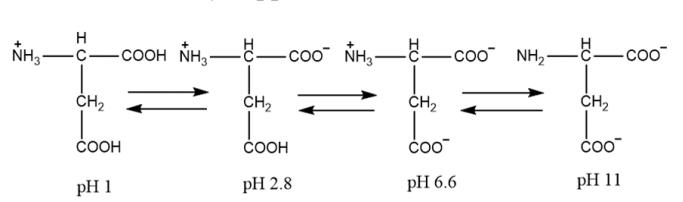
Hình 1. Sự ion hóa của axit aspartic (Asp) ở các giá trị pH khác nhau. Điểm đẳng điện của Asp là ở pH 2,98.
Amino axit có đặc điểm của ion lưỡng cực là độ hòa tan của AA quanh điểm đẳng điện kém. Điểm đẳng điện (pI) của phân tử amino axit được định nghĩa là giá trị pH, tại đó phân tử, trong dung dịch, không giải phóng bất kỳ điện tích nào (điện tích trung tính). Giá trị pI của amino axit là hàm số của giá trị pH của các nhóm ion hóa trong phân tử. Các điều kiện tách amino axit có thể được thay đổi theo cách mà các điểm đẳng điện, đối với tất cả amino axit, sẽ đạt được tại các thời điểm khác nhau. Sau đây là một ví dụ về axit aspartic (Hình 1) trải qua các điện tích khác nhau ở độ pH khác nhau (Csapó et al., 2008).
Ở điều kiện rất axit (pH xấp xỉ 1), axit aspartic (Asp) có một điện tích dương. Nếu giá trị pH tăng lên, số lượng lớn hơn các phân tử nằm trong nhóm α-carboxyl sẽ có điện tích âm lên đến giới hạn pH xấp xỉ 2,98 khi tất cả chúng loại bỏ nó. Tình huống này (ở pH 2,98) trong đó Asp không loại bỏ bất kỳ điện tích nào (điện tích trung tính) được gọi là điểm đẳng điện của Asp. Nhóm cacboxylic trong chuỗi bên có ít axit hơn axit αcarboxylic và nồng độ các ion hydro đủ để ngăn chặn sự ion hóa của nó. Nếu giá trị pH tăng lên 6,6, nhóm cacboxylic của chuỗi bên sẽ bị ion hóa và phân tử sẽ có hai điện tích âm và một điện tích dương, và nếu pH tăng lên 11,0, phân tử sẽ chỉ loại bỏ hai điện tích âm (Csapó et al., 2008). Ví dụ về cấu trúc hóa học cùng với các giá trị pI được biên soạn trong Bảng 1.
Phân tích định lượng các axit amin bằng các phương pháp phân tích hiện đại và nhạy cảm thường thấy nhất trong hầu hết các sản phẩm thực phẩm, dưới dạng AA tự do hoặc dưới dạng các khối xây dựng của protein (Otter, 2012). Phân tích thành phần của AA có thể cung cấp một cách tuyệt vời để theo dõi giá trị dinh dưỡng của thực phẩm. Điều này dựa trên thực tế rằng AA là một phần của protein có vai trò quan trọng trong các khía cạnh dinh dưỡng (Gałęzowska và cộng sự, 2021). Do khả năng tách AA trong các mẫu thực phẩm, các kỹ thuật sắc ký, đặc biệt là sắc ký lỏng hiệu năng cao (HPLC) được sử dụng rộng rãi để phân tích định lượng AA
Những trở ngại chính đối với việc tách và phân tích định lượng AA trong các sản phẩm thực phẩm bằng HPLC là thực tế là một số AA có tính phân cực, do đó, AA không được giữ lại đủ trong cột đảo ngược HPLC. Ngoài ra, hầu hết các AA có bản chất không tạo màu, không phù hợp để phát hiện bằng máy dò UV-Vis và huỳnh quang (Ferré và cộng sự, 2019). Do đó, một số tác nhân dẫn xuất được đưa vào và sử dụng trong quá trình phân tích AA bằng HPLC để phát hiện bằng máy dò UV-Vis và huỳnh quang, các máy dò HPLC thông dụng có sẵn trong phòng thí nghiệm phân tích (Callejón và cộng sự, 2010). Hình 1 cho thấy cấu trúc hóa học của AA trong đó chỉ có Cysteine (Cys) và AA thơm của Phenylalanine (Phe), Tyrosine (Tyr), Tryptophan (Trp) và Histidine (His) có thể dễ dàng phát hiện bằng máy dò UV. Về cơ bản, AA có thể được phát hiện trực tiếp bằng đầu dò UV-Vis vì AA hấp thụ bức xạ UV ở bước sóng 190-210 nm. Thật không may, phần lớn dung môi và các thành phần khác của mẫu cũng được hấp thụ trong vùng này khiến việc tách AA và dung môi trở nên khó khăn, do đó quá trình dẫn xuất hóa là một phương pháp tuyệt vời để phân tích AA bằng HPLC kết hợp với đầu dò UV-Vis hoặc huỳnh quang (Ta et al., 2021)
Mục tiêu của bài đánh giá này là cung cấp tổng quan về ứng dụng của HPLC sử dụng các loại đầu dò khác nhau để phân tích AA trong các mẫu thực phẩm. Đặc biệt nhấn mạnh đến ứng dụng của đầu dò UV-Vis, do đó, một số tác nhân dẫn xuất thường được sử dụng để dẫn xuất AA được phát hiện bằng đầu dò UV-Vis hoặc huỳnh quang đã được nêu bật. Trong phần cuối, ứng dụng của HPLC để phân tích AA được dẫn xuất bằng cách sử dụng dẫn xuất trước cột hoặc sau cột cũng đã được trình bày.
2. Phân tích Amino Acid bằng HPLC
HPLC đã trở thành một phương pháp rất phổ biến cung cấp các kỹ thuật phân tích có thể tái tạo trong phân tích thực phẩm. HPLC trở thành phương pháp được lựa chọn để xác định AA trong các mẫu thực phẩm do khả năng cung cấp tính năng thông lượng cao, cung cấp khả năng tách AA tốt trong thời gian tương đối ngắn và định lượng mức AA thấp với độ nhạy tốt. Tuy nhiên, kỹ thuật này có một số vấn đề liên quan đến nhu cầu chuẩn bị mẫu rộng rãi để loại bỏ các nhiễu có thể có trong các mẫu thực phẩm (Csapó et al., 2008). Phân tích AA bằng HPLC bao gồm ba bước chính là (1) thủy phân từng AA từ xương sống protein, (2) tách từng AA bằng quy trình HPLC và (3) phát hiện và định lượng các AA đã tách (Otter, 2012).
2.1 Chuẩn bị mẫu
Chuẩn bị mẫu thường là bước quan trọng trong quá trình phân tích AA. Mục tiêu chính của việc chuẩn bị mẫu trong quá trình phân tích AA bằng HPLC là giải phóng hoàn toàn AA khỏi ma trận mẫu với sự can thiệp tối thiểu dẫn đến khả năng thu hồi chất phân tích ở mức chấp nhận được. Trong quá trình chuẩn bị mẫu, cần thực hiện tối ưu hóa để có được các điều kiện lý tưởng như sử dụng tối thiểu dung môi hóa học và thuốc thử để hỗ trợ kỹ thuật phân tích xanh. Điều kiện tối ưu của quá trình chuẩn bị mẫu sẽ giúp giảm thời gian phân tích và các nguồn lỗi, tăng độ nhạy và cho phép xác định và định lượng AA một cách rõ ràng (Gałęzowska và cộng sự, 2021).
AA có thể ở dạng AA tự do hoặc dạng xương sống protein. Việc giải phóng AA từ xương sống protein trong các mẫu thực phẩm là một nhiệm vụ đầy thách thức vì các điều kiện thủy phân khác nhau là cần thiết để giải phóng AA tối ưu trong các ma trận thực phẩm khác nhau. Thủy phân protein thành AA là một bước quan trọng để phân tích góp phần vào nguồn chính gây ra các lỗi phân tích (Rutherfurd và Gilani, 2009). Về mặt khái niệm, quy trình thủy phân AA rất đơn giản trong đó việc sử dụng axit (HCl) hoặc bazơ của NaOH 4,2 M (105°C trong 20 giờ) tại một thời điểm và nhiệt độ nhất định có khả năng thủy phân liên kết peptide giữa các AA liền kề để giải phóng AA tự do (Hirs và cộng sự, 1954; Dai và cộng sự, 2014). Quy trình này có thể thủy phân hiệu quả hầu hết các liên kết peptide.
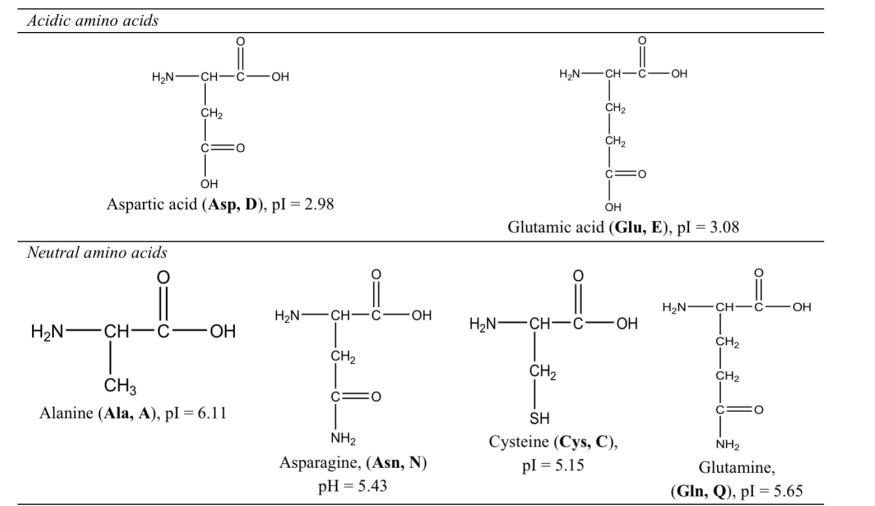
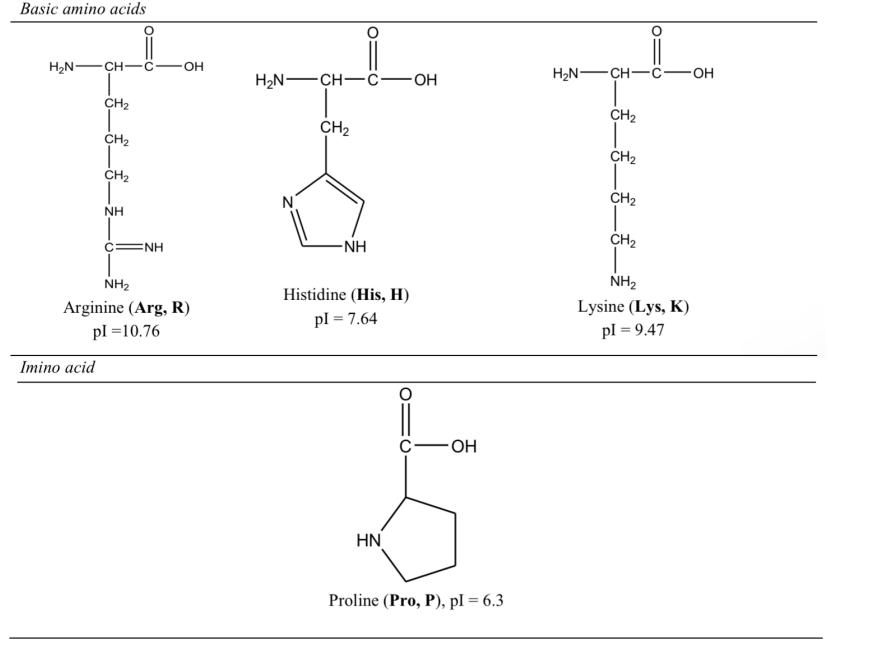
Bảng 1. Các axit amin phổ biến cùng với cấu trúc hóa học, điểm đẳng điện (pI) và các ký hiệu sử dụng ba chữ cái và một chữ cái (Csapó et al., 2008).
Các phương pháp này hiệu quả và tiện lợi vì HCl có thể dễ dàng bốc hơi hoặc dễ dàng trung hòa bằng NaOH sau khi quá trình thủy phân hoàn tất. Nhưng đồng thời, nồng độ của một số axit amin nhất định bị giảm hoặc thậm chí bị phá hủy hoàn toàn. Ngoài ra, một số AA thu được trong quá trình thủy phân protein bằng HCl hoặc NaOH áp dụng nhiệt là không ổn định (Mæhre và cộng sự, 2018). Ma trận mẫu cũng ảnh hưởng đến quá trình thủy phân AA do đó điều kiện thủy phân phải được tối ưu hóa cho mọi AA và loại mẫu thực phẩm.
Quá trình thủy phân protein bằng axit có thể dẫn đến sự phá hủy Trp, chuyển đổi Glutamine (Gln), Asparagine (Asn) và Cys thành Axit Glutamic (Glu), Asp và cystine tương ứng, trong khi thủy phân bằng bazơ [NaOH, KOH, LiOH và Ba(OH)2] ở 105–110°C trong 20–24 giờ dẫn đến mất ít Trp và phân hủy Arg, Asn, Cys, cysteine, Gln, Met, Ser và Thr. Để khắc phục một số vấn đề liên quan đến việc mất các gốc AA, enzyme thường được áp dụng để thủy phân protein từ mô động vật và thực phẩm (Wu et al., 2011). Một số nỗ lực đã được thực hiện bằng cách bảo vệ các nhóm amide của Gln và Asn bằng bis(1,1-trifluoroacetoxy) iodobenzene và bằng cách oxy hóa Cys bằng axit performic để tạo thành axit cysteic trước khi thủy phân protein. Do Trp bị phá hủy trong quá trình thủy phân thông thường, một số tác nhân bảo vệ như phenol, 2-mercaptoethanol (ME), axit thioglycolic, indole và tryptamine đã được sử dụng để thu hồi tryptophan (Ingle và Lill, 2007)
Nghiên cứu tìm ra điều kiện tối ưu có khả năng rút ngắn thời gian thủy phân, có thông lượng cao và mang lại độ ổn định tốt cho một số AA vẫn đang tiếp tục (Otter, 2012). Điều này là do thực tế là tính hoàn chỉnh của quá trình thủy phân protein bị ảnh hưởng bởi nhiều yếu tố, bao gồm nền mẫu, nhiệt độ, thời gian, thuốc thử và phụ gia thủy phân (Dai và cộng sự, 2014). Marino và cộng sự (2010) đã so sánh sáu kết hợp (tác nhân thủy phân và điều kiện nhiệt độ-thời gian) với phương pháp AOAC (thủy phân bằng cách đun sôi HCl 6 N trong chân không ở 110 ° C trong 24 giờ) để thủy phân AA trong các mẫu sữa. Kết quả cho thấy việc sử dụng HCl 6 N ở 160 ° C trong 1 giờ cho kết quả tương đương với phương pháp chuẩn AOAC với ưu điểm là thời gian thủy phân ngắn hơn. Sử dụng điều kiện tối ưu này, giá trị thu hồi trung bình của các axit amin đơn là 98,38%.
Quy trình thủy phân protein là bước giới hạn tốc độ để phân tích AA. Để tăng tốc quá trình thủy phân, một số cải tiến đã được thực hiện. Thủy phân axit hỗ trợ vi sóng đã được khám phá như một phương pháp thủy phân AA trong phấn hoa đơn hoa. Thủy phân được thực hiện bằng cách sử dụng HCl 6 M với việc bổ sung phenol (0,5%, w/v) trong lò vi sóng ở 150°C trong 60 phút ở áp suất 70 psi (Themelis et al., 2019). Việc sử dụng vi sóng trong quá trình thủy phân có khả năng làm giảm đáng kể thời gian thủy phân trong đó có thể đạt được quá trình thủy phân hoàn toàn bằng cách chiếu xạ vi sóng ở 175°C trong 10 phút (Ingle và Lill, 2007). Các phương pháp khác để thủy phân protein là sử dụng các enzyme có khả năng cắt liên kết peptide bằng cách sử dụng một loạt các protease phổ rộng, nhưng một số phương pháp dùng enzyme chỉ tạo ra quá trình thủy phân protein một phần (Asano, 2019).
Thật vậy, việc lựa chọn các enzyme hỗn hợp (protease) có tính đặc hiệu phổ rộng để cắt liên kết peptide trong protein có thể dẫn đến việc thu hồi Glu, Gln, Asp và Asn một cách thỏa đáng (Tavano, 2013). Phương pháp này sẽ phù hợp để thử nghiệm do các quy trình dẫn xuất đơn giản, các dẫn xuất ổn định và khả năng phản ứng với chính và phụ (Rebane và Herodes, 2012).
2.2 Phân tách axit amin bằng HPLC
Trong những thập kỷ gần đây, các phương pháp HPLC sử dụng các đầu dò UV-Vis và huỳnh quang cụ thể đã được áp dụng để phân tích AA trong thủy phân protein có nguồn gốc từ các mẫu thực phẩm. Vì hầu hết các AA không phải là chất tạo màu và không phải là chất huỳnh quang, nên việc dẫn xuất AA bằng các thuốc thử thích hợp để tạo ra các hợp chất tạo màu và hoặc huỳnh quang là cần thiết để phát hiện AA một cách nhạy bén.
Hiện nay, các phương pháp HPLC cho AA liên quan đến quá trình dẫn xuất hóa trước cột hoặc sau cột của AA (Callejón và cộng sự, 2010). Phương pháp dẫn xuất hóa trước cột thường là tách pha đảo ngược, trong khi dẫn xuất hóa sau cột hữu ích cho việc tách AA bằng nhựa trao đổi cation và có ưu điểm là loại bỏ các chất gây nhiễu trước khi phản ứng dẫn xuất hóa xảy ra. So với sắc ký trao đổi ion, độ phân giải AA trên các cột pha đảo ngược nhanh hơn và vượt trội hơn nhưng tuổi thọ của chúng ngắn hơn do có thể phát triển áp suất ngược. Do tính linh hoạt của nó, HPLC pha đảo ngược hiện được ưa chuộng để phân tích AA trong thủy phân protein (Ferré và cộng sự, 2019).
Một số tác nhân dẫn xuất đã được giới thiệu và sử dụng để dẫn xuất các axit amin như đã được Callejón và cộng sự, 2010 và Dai và cộng sự, 2014 đánh giá bao gồm ortophtalaldehyde (OPA), 7-phenanthroline-5,6-dione, phenylisothiocyanate (PITC), được gọi là thuốc thử Edman, 9-fluorenylmethyl chloroformate, 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate, ammonium-7-fluorobenzo-2-oxa-1,3-diazole-4-sulfonate, butylisothiocyanate, dimethylaminoazobenzene-4-sulfonyl chloride, 1-dimethylaminonaphthalene-5-sulfonyl chloride, diethyl 2 (ethoxymethylidene) propanedioate, 2,4-dinitrofluorobenzene, fluorescamine, 4-fluoro-7-nitro2,1,3-benzoxadiazole, fluorescein-5-isothiocyanate, 1-fluoro-2,4- dinitrobenzene, 1-fluoro-2,4-dinitrophenyl-5-L-alanine amide, naphthalene-2,3-dialdehyde và ninhydrin. Một số nhà khoa học liên tục phát triển một số tác nhân dẫn xuất cung cấp các bước đơn giản và các dẫn xuất nhạy cảm để phát hiện bằng máy dò HPLC của UVVis và huỳnh quang (Cardinael et al., 2015).
Gần đây, một tác nhân dẫn xuất mới của 2-(9-acridone)-ethyl chloroformate đã được tổng hợp và ứng dụng để phân tích định lượng AA tự do bằng HPLC sử dụng đầu dò huỳnh quang ở bước sóng kích thích và phát xạ lần lượt là 268 nm và 438 nm (Gao et al., 2020). Jin et al. (2021) cũng đã phát triển một thuốc thử dẫn xuất mới của DBD-trans-2-methyl-L-proline để dẫn xuất trước cột AA được phát hiện bằng đầu dò huỳnh quang ở bước sóng kích thích và phát xạ lần lượt là 450 nm và 560 nm.
Quy trình dẫn xuất hóa của AAS có thể được thực hiện bằng cách sử dụng dẫn xuất hóa trước cột (trước khi tiêm) hoặc dẫn xuất hóa sau cột (sau khi chất phân tích ra khỏi cột) và hiếm hơn là sử dụng dẫn xuất hóa cột. Tác nhân dẫn xuất hóa được sử dụng phổ biến nhất là orto-phtalaldehyde (OPA) khi có mặt 2-mercaptoethanol hoặc axit 3-mercaptopropionic phản ứng với AA chính để tạo thành một chất cộng hợp huỳnh quang cao. OPA không phản ứng với AA thứ cấp, do đó, trong quy trình phân tích, OPA được kết hợp với 6-aminoquinolyl-N-hydroxysuccinymidyl carbamate (AQC) (Gwatidzo và cộng sự, 2013). Sự huỳnh quang của các dẫn xuất OPA được theo dõi ở bước sóng kích thích và phát xạ lần lượt là 340 và 455 nm. Giới hạn phát hiện là 50 mol đối với AA. Phương pháp OPA cung cấp một công cụ hữu ích để theo dõi thành phần AA trong protein của mô động vật và thực phẩm (Dai et al., 2014). Một số nhược điểm cũng được đáp ứng bao gồm thời gian dẫn xuất dài (PITC, dansyl chloride), cần loại bỏ thuốc thử dư sau khi dẫn xuất (PITC, FMOC-Cl), dẫn xuất không ổn định, không phản ứng với amin thứ cấp (OPA) và hiệu quả dẫn xuất giảm khi có chất đệm và chất tẩy rửa (FMOC, PITC).
3. Ứng dụng HPLC pha đảo để phân tích AA trong mẫu thực phẩm
Đối với ứng dụng ma trận thực phẩm, phân tích AA cần tiếp tục giảm thiểu thời gian thủy phân, tăng thông lượng, giảm sự phân hủy AA và phương pháp nhanh chóng, ví dụ như sử dụng LC không dẫn xuất với phát hiện MS song song ba tứ cực (Thiele và cộng sự, 2008; Qiu và cộng sự, 2020). Nhưng tầm quan trọng của các phương pháp này phải đủ mạnh để xử lý nhiều loại sản phẩm thực phẩm hiện đang được sản xuất (Otter, 2012). Bảng 2 tổng hợp một số ứng dụng thành công của phương pháp HPLC sử dụng cột pha đảo ngược xuất hiện trong các ấn phẩm khoa học từ năm 2019 đến 2021. Đặc biệt nhấn mạnh đến việc sử dụng các tác nhân dẫn xuất được áp dụng trong quá trình phân tích thành phần AA để phát hiện bằng đầu dò UV-Vis hoặc huỳnh quang. Ngày nay, xu hướng HPLC thường được thay thế bằng các kỹ thuật tự động cho hệ thống sắc ký pha đảo ngược hoặc sắc ký cặp ion (Held và cộng sự, 2011).
Sự phát triển của phân tích AAs gắn liền với việc thu nhỏ thiết bị và sử dụng sắc ký đa chiều để tách hoàn toàn các chất phân tích từ hợp chất không phân cực đến hợp chất phân cực.
4. Kết luận
HPLC sử dụng đầu dò UV-Vis hoặc huỳnh quang được coi là phương pháp tiêu chuẩn để xác định AA đã được dẫn xuất trước đó bằng một số thuốc thử trong mẫu thực phẩm, mang lại độ đặc hiệu và độ nhạy chấp nhận được. Trong tương lai, phương pháp HPLC sử dụng các tác nhân dẫn xuất mới được phát triển, cung cấp tính đơn giản và thân thiện với môi trường phải được phát triển và xác nhận để hỗ trợ các kỹ thuật phân tích xanh.
Bảng 2. Ví dụ về ứng dụng HPLC để phân tích các axit amin dẫn xuất trong các mẫu thực phẩm bằng cách sử dụng một số tác nhân dẫn xuất