Phân tích axit amin
Phân tích axit amin
Phân tích axit amin đóng vai trò quan trọng trong việc làm sáng tỏ cấu trúc peptide và protein. Tuy nhiên, với sự ra đời của giải trình tự khối phổ, phương pháp này hiện ít được sử dụng hơn. Sau khi tinh chế, các mẫu peptide được thủy phân thành các axit amin cấu thành khi có axit mạnh và nhiệt. Sau khi thủy phân, các axit amin được tách ra bằng RPLC và phát hiện bằng phương pháp dẫn xuất trước cột với thuốc thử huỳnh quang hoặc bằng phương pháp dẫn xuất sau cột với ninhydrin. Thành phần của các axit amin thu được phải phù hợp với số nguyên dự đoán cho các gốc axit amin cấu thành. Bảng 1 liệt kê thành phần axit amin của hai đỉnh sắc ký trong Hình 1 thu được từ quá trình tiêu hóa trypsin của hormone tăng trưởng ở bò. Dữ liệu trình bày trong Bảng 1 thường cung cấp thông tin nhận dạng và chỉ định rõ ràng các đoạn trypsin. Tuy nhiên, có thể quan sát thấy độ lệch so với giá trị số nguyên thực đối với một số axit amin như threonine, serine, tryptophan và methionine.
Bảng 1. Dữ liệu thành phần axit amin của hai peptit tryptic có nguồn gốc từ hormone tăng trưởng ở bò
| Amino acid | T5 | T9 | ||
|---|---|---|---|---|
| Empty Cell | Theor | Exp | Theor | Exp |
| Aspartic acid | 1 | 1.11 | 2 | 2.07 |
| Glutamic acid | 3 | 3.12 | – | – |
| Serine | 2 | 1.91 | 2 | 1.93 |
| Glycine | 1 | 1.36 | 1 | 1.19 |
| Histidine | – | – | – | – |
| Arginine | – | – | 1 | 1.04 |
| Threonine | 3 | 3.02 | 2 | 1.95 |
| Alanine | 2 | 1.99 | – | – |
| Proline | 2 | 2.20 | – | – |
| Tyrosine | 1 | 1.10 | – | – |
| Valine | – | – | 2 | 1.89 |
| Methionine | – | – | – | – |
| Cysteine | – | – | – | – |
| Isoleucine | 2 | 2.24 | – | – |
| Leucine | – | – | 1 | 1.16 |
| Phenylalanine | 2 | 2.04 | 2 | 1.99 |
| Lysine | 1 | 1.05 | – | – |
Sàng lọc sơ sinh và các lỗi bẩm sinh về chuyển hóa
Phân tích axit amin
Phân tích axit amin hữu ích trong việc đánh giá tình trạng tăng amoniac máu, chậm phát triển, co giật và nhiễm toan chuyển hóa. Các hệ thống HPLC chuyên dụng đã được sử dụng để đo axit amin từ những năm 1950. Phát hiện axit amin bằng phương pháp hấp thụ hoặc huỳnh quang đòi hỏi phải khử protein và dẫn xuất hóa có thể được thực hiện trước hoặc sau khi tách. Hình 48.1A minh họa sắc ký đồ axit amin được tạo ra bằng phương pháp sắc ký trao đổi ion. Axit amin được tách dựa trên pKa của chúng với độ dốc đệm có cường độ ion tăng dần. Với phương pháp này, axit amin có tính axit được rửa giải trước, sau đó là axit amin trung tính và sau đó là axit amin bazơ. Ninhydrin là thuốc thử dẫn xuất hóa sau cột phổ biến nhất đối với axit amin. Thuốc thử này phản ứng với các nhóm amino chính để tạo ra hợp chất màu tím có độ hấp thụ cực đại ở 570 nm. Diện tích đỉnh của mỗi hợp chất được so sánh với một chuẩn hiệu chuẩn bên ngoài. Ngoài ra, một chuẩn nội được thêm vào cả mẫu bệnh nhân và chuẩn để điều chỉnh bất kỳ sự thay đổi nào về thể tích tiêm hoặc phản ứng của thuốc thử.
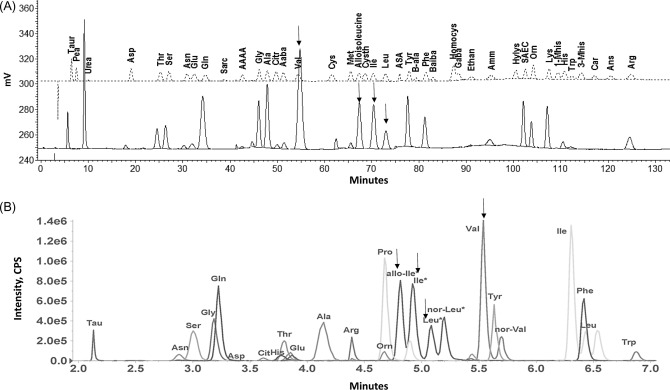
Hình 48.1. (A) Phân tích axit amin huyết tương của một bệnh nhân mắc bệnh nước tiểu siro cây phong bằng phương pháp sắc ký trao đổi ion. Đường chấm: chuẩn hiệu chuẩn. Đường liền: mẫu bệnh nhân. (B) Phương pháp sắc ký lỏng giám sát phản ứng đa – phổ khối song song. Mũi tên: axit amin chẩn đoán (alloisoleucine, isoleucline, leucine và valine).
Phân tích axit amin phát hiện tất cả các hợp chất chứa amino, bao gồm các hợp chất không phải axit amin như urê và amoniac. Một số axit amin khác không có trong protein, nhưng hỗ trợ chẩn đoán IEM, cũng được xác định. Chúng bao gồm alloisoleucine, ornithine, citrulline và axit argininosuccinic (ASA). Các hiện tượng lạ trong chế độ ăn uống và thuốc, cũng như các axit amin bất thường đặc trưng của nhiều IEM khác nhau, cũng có thể được xác định bằng phương pháp này. Việc xác định các hợp chất rửa giải dựa trên thời gian lưu và thứ tự rửa giải tương đối. Phân tích axit amin bằng phương pháp phát hiện bằng mắt thường hoặc huỳnh quang không cung cấp khả năng xác định tuyệt đối bất kỳ hợp chất nào. Điều này thường đủ đối với các mẫu chỉ chứa các axit amin sinh lý bình thường, nhưng sự hiện diện của thuốc hoặc các axit amin bất thường do IEM làm phức tạp việc giải thích. Sắc ký trao đổi ion là phương pháp được sử dụng phổ biến nhất để phân tích axit amin; tuy nhiên, nhiều phòng thí nghiệm hiện đang bắt đầu áp dụng các phương pháp LC–MS/MS [1,2]. Các xét nghiệm LC–MS/MS để phân tích axit amin cung cấp độ đặc hiệu và độ nhạy phân tích cao hơn, cũng như thời gian phân tích nhanh hơn (Hình 48.1B).
Huyết tương là mẫu được ưu tiên để phân tích axit amin nhằm chẩn đoán hầu hết các rối loạn. Khi có thể, máu nên được lấy khi đang nhịn ăn (ít nhất 3–4 giờ sau khi ăn) hoặc sau khi nuôi dưỡng qua đường tĩnh mạch trong 30–60 phút. Huyết tương nên được tách càng sớm càng tốt và đông lạnh nếu việc phân tích bị chậm trễ. Nếu sử dụng huyết thanh, mẫu nên được ly tâm ngay sau khi đông máu [3]. Cysteine và homocysteine liên kết với protein trong mẫu huyết tương và có thể bị giảm giả nếu bảo quản không đúng cách. Tan máu sẽ dẫn đến nồng độ aspartate, glutamate và taurine tăng giả.
Phân tích axit amin trong nước tiểu thường ít thông tin hơn phân tích mẫu huyết tương do khoảng tham chiếu rộng đối với bài tiết nước tiểu của hầu hết các axit amin. Khoảng tham chiếu đối với axit amin trong nước tiểu thường được chuẩn hóa theo creatinin. Bài tiết axit amin đặc biệt cao trong thời kỳ trẻ sơ sinh và giảm dần theo tuổi. Nhìn chung, phân tích axit amin trong nước tiểu nên được dành riêng để đánh giá các bất thường về vận chuyển ống thận và các rối loạn vận chuyển axit amin, chẳng hạn như không dung nạp protein lysinuric (đặc trưng bởi sự gia tăng lysine và các axit amin dibasic khác trong nước tiểu), bệnh Hartnup và cystin niệu. Rối loạn chức năng tổng quát của tái hấp thu ống lượn gần (hội chứng Fanconi), dẫn đến tăng nhiều axit amin trong nước tiểu, có thể được thấy ở một số IEM, bao gồm các rối loạn ty thể. Phân tích axit amin trong dịch não tủy là điều cần thiết trong chẩn đoán các rối loạn dẫn truyền thần kinh như NKH, các rối loạn thiếu hụt serine và động kinh phụ thuộc pyridoxal-phosphate.
Các khoảng tham chiếu liên quan đến độ tuổi đã được công bố cho nhiều loại mẫu khác nhau. Bảng 48.3 liệt kê các IEM thường được chẩn đoán bằng hồ sơ axit amin và các bất thường về axit amin liên quan. Nhìn chung, glutamine, alanine và valine là các đỉnh lớn nhất trong sắc ký đồ. Trong nước tiểu, amoniac và urê chiếm ưu thế, trong khi glycine và histidine là các axit amin thường có nồng độ cao nhất. Glutamine là axit amin dồi dào nhất trong dịch não tủy bình thường, không có tế bào. Phân tích axit amin nên được thực hiện định lượng, vì phân tích định tính không đủ để xác định một số thay đổi tinh vi hơn về nồng độ axit amin đặc trưng cho một số rối loạn. Khi đã chẩn đoán được IEM, phân tích axit amin huyết tương có thể là một phần quan trọng trong quá trình quản lý, đặc biệt là đối với các rối loạn chu trình urê (UCD) và những tình trạng đòi hỏi phải hạn chế một số axit amin đã chọn.
Bảng 48.3. Các lỗi bẩm sinh về chuyển hóa liên quan đến bất thường về axit amin.
| IEM | Abnormal amino acida |
|---|---|
| Maple syrup urine disease | ↑Alloisoleucine, isoleucine, leucine, and valine |
| Lysinuric protein intolerance (low in serum) | Arginine, lysine, and ornithine (↑urine/↓serum) |
| Urea cycle defects | ↑Glutamine (see Table 48.6) |
| Glycine encephalopathy | ↑Glycine (serum and CSF) |
| Homocystinuria | ↑Methionine and ↑homocysteine |
| Phenylketonuria | ↑Phenylalanine and ↓tyrosine |
| Tyrosinemia types 1–3 | ↑Tyrosine |
| Hartnup disease | ↑Neutral amino acids (urine) |
IEM, Lỗi bẩm sinh về chuyển hóa; CSF, dịch não tủy.
Phát hiện bất thường về axit amin trong huyết thanh trừ khi có chỉ định
Giới thiệu
Phân tích axit amin là một trong những quy trình phân tích được sử dụng rộng rãi nhất. Nó được sử dụng để làm sáng tỏ cấu trúc của protein, chẩn đoán tình trạng bệnh và xác định giá trị dinh dưỡng của thực phẩm, chỉ để nêu một vài ví dụ. Các loại mẫu có thể được chia thành hai loại chính, thủy phân protein và mẫu sinh học.
Để xác định thành phần axit amin của protein, một mẫu tinh khiết cao được thủy phân trong điều kiện axit thành các axit amin cấu thành của nó. Thành phần axit amin của protein được xác định từ nồng độ của từng axit amin và từ trọng lượng phân tử của protein. Vì mẫu protein thường rất tinh khiết nên thành phần của thủy phân chỉ giới hạn ở các axit amin thường thấy trong protein. Người ta không cần phải lo lắng về các amin nội sinh khác có thể ảnh hưởng đến quá trình phân tích. Hầu hết các máy phân tích axit amin thương mại chỉ định lượng 20 axit amin thường thấy trong protein. Do đó, thách thức lớn nhất đối với ứng dụng này là tạo ra một phương pháp có độ nhạy đủ để xác định chính xác thành phần axit amin của một lượng rất nhỏ (<1 μg) protein được phân lập từ gel hoặc màng nitrocellulose.
Việc xác định axit amin trong các mẫu sinh lý đặt ra một loạt các thách thức khác nhau. Các mẫu máu, nước tiểu, dịch não tủy và mô là những loại phổ biến nhất trong danh mục này. Trong những trường hợp này, thành phần axit amin của hỗn hợp thường không được xác định rõ ràng. Tổng số axit amin cần xác định có thể nhỏ hơn hoặc lớn hơn so với thủy phân protein, tùy thuộc vào loại mẫu và mục tiêu phân tích. Nhiều axit amin không phải protein, chẳng hạn như taurine và γ-aminobutyrate (GABA), được đưa vào xét nghiệm axit amin sinh lý. Ngược lại với thủy phân protein, là những mẫu khá “sạch”, hầu hết các chất lỏng và mô sinh học đều chứa các amin nội sinh có thể gây trở ngại cho việc xác định axit amin.
Phân tích axit amin cysteine và tryptophan của ABRF92-AAA
I Giới thiệu
Phân tích axit amin là một trong những kỹ thuật phân tích chính được sử dụng trong môi trường sinh hóa và công nghệ sinh học. Đây vẫn là phương pháp được lựa chọn để định lượng protein/peptit đáng tin cậy và trong nhiều trường hợp cung cấp thông số hữu ích trong việc mô tả đặc tính của peptide và protein. Ngoài ra, phương pháp này bổ sung cho các phương pháp phân tích cấu trúc khác, đặc biệt là phân hủy Edman và khối phổ. Do đó, việc đánh giá chất lượng kết quả thu được từ nhiều cuộc điều tra khác nhau là rất hữu ích.
Là một phần của quá trình tiếp tục hàng năm các nghiên cứu thử nghiệm hợp tác của Hiệp hội các cơ sở tài nguyên sinh học phân tử (ABRF) (1–5), nghiên cứu này tập trung vào việc xác định hai chất có vấn đề là cystine/cysteine và tryptophan. Các thử nghiệm trước đây (1–5) đã chỉ ra rằng độ chính xác trung bình để xác định cystine/cysteine và tryptophan thấp hơn so với các chất cặn khác, mặc dù một số phòng thí nghiệm báo cáo kết quả tuyệt vời. Mục đích của nghiên cứu này là đánh giá các phương pháp phân tích cystine/cysteine và tryptophan và xác định các phương pháp có thể được sử dụng một cách đáng tin cậy để định lượng các chất cặn này.