Những phát triển gần đây trong việc sử dụng LCMS trong quá trình hóa dược
Hướng dẫn tham khảo những phát triển gần đây trong việc sử dụng LCMS trong quá trình hóa dược


Phần cứng khối phổ
Sự đa dạng của các máy phân tích khối lượng có khả năng hoạt động LCMS có thể được định nghĩa là phương pháp mà khối lượng được phân biệt và bằng thí nghiệm được thực hiện. Tóm lại, máy dò tứ cực đơn thường được sử dụng để phân tích khối lượng đơn giản; bẫy ion / tứ cực ba để phân tích phân mảnh; Thời gian bay (TOF) cho các phép đo độ phân giải cao và Q-TOF cho phép đo độ phân giải cao của các mẫu phân mảnh.Phân tích khối lượng đơn giản sẽ cung cấp dữ liệu ion phân tử ở mức nguyên và rất hữu ích như một màn hình sơ bộ để xem liệu mẫu có ion hóa trong các điều kiện vận hành hay không. Điều này thường được thực hiện để xác nhận sự hiện diện của một ion trong mẫu trước khi xem xét các kỹ thuật phức tạp hơn hoặc được sử dụng trong định lượng. Phân tích phân mảnh được thực hiện để hỗ trợ xác định các thành phần trong hỗn hợp phân tách trong điều kiện LC.
Dữ liệu được tiết lộ bởi quá trình này xác định các mảnh nhỏ hơn mà khi liên kết với nhau tạo thành ion phân tử được thấy trong phép phân tích khối lượng đơn giản. Việc sử dụng ba tứ cực hoặc dụng cụ bẫy ion liên quan đến các thí nghiệm phân mảnh vì có hai tứ cực ở hai bên của ô va chạm. Ô va chạm là nơi xảy ra sự phân mảnh ion nhưng chùm ion có thể quét hoặc chọn lọc trước hoặc sau ô va chạm. Điều này về cơ bản có nghĩa là bộ ba tứ cực có khả năng quét các ion / mảnh phân tử hoặc theo dõi chọn lọc các ion / mảnh phân tử riêng lẻ. Đây là một kỹ thuật rất mạnh mẽ vì nó có thể được sử dụng như một yếu tố quyết định chính trong việc đánh giá cấu trúc và một lần nữa có thể được sử dụng để định lượng.
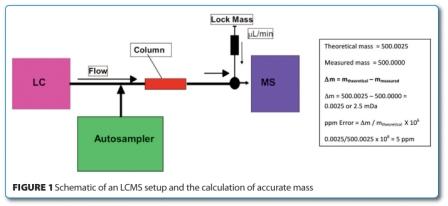
Việc bổ sung chất chuẩn tham chiếu (hoặc khối lượng khóa) và sử dụng máy dò có độ phân giải cao cho phép thu được khối lượng đến bốn chữ số thập phân và do đó, thành phần nguyên tố được đo. Điều này có thể được so sánh với tính toán và là một kỹ thuật rất phổ biến trong việc xác định ẩn số. Như một nguyên tắc hướng dẫn, điều này phải phù hợp trong phạm vi 5ppm cho công thức trong Hình 1 ở trên (mặc dù điều này phụ thuộc nhiều vào khối lượng lý thuyết) và kỹ thuật hoạt động tốt nhất nếu lịch sử mẫu được biết rõ vì điều này sẽ hạn chế các tham số tiềm năng.
Ưu điểm đáng kể của LCMS so với các đầu báo sắc ký lỏng khác là chất lượng của thông tin về việc phát hiện pic và do đó thường được sử dụng như một trong những bộ kỹ thuật để xác định thông tin cấu trúc trên một thành phần.
Việc sử dụng LCMS trong phát triển quy trình dược phẩm
Việc sử dụng LCMS trong môi trường dược phẩm đã được thiết lập tốt vì các nhà phân tích luôn tìm kiếm thông tin chất lượng tốt nhất từ các máy dò và tỷ lệ chi trả liên quan đến việc thiết lập đã giảm đáng kể. Điểm khởi đầu cho phần lớn những gì được mô tả dưới đây là trong các phòng thí nghiệm QA / QC công nghiệp (do dữ liệu định tính và định lượng rõ ràng được tạo ra) mà còn ở các hợp tác học thuật. Gần đây, việc áp dụng LCMS (song song với các kỹ thuật định tính và lý thuyết khác) để phát triển quy trình đã đạt được động lực đáng kể. Dưới đây là một số phát triển gần đây trong việc sử dụng LCMS được áp dụng để thay đổi phát triển quy trình, một lĩnh vực rất quan trọng trong hóa dược đã được đầu tư toàn cầu trong thập kỷ qua.
Ứng dụng dược phẩm của LCMS
Trong một công bố gần đây từ AstraZeneca, quá trình tổng hợp chất ức chế kinase SRC mạnh (AZD0530) đã được tiết lộ với việc sử dụng LCMS và chìa khóa mô hình phân tử cho sự phát triển. Con đường tổng hợp sơ bộ liên quan đến ba lần thay thế nucleophin thơm liên tiếp và trọng tâm của nghiên cứu này là phản ứng SnAr cuối cùng tạo ra mức độ hình thành sản phẩm phụ đáng kể như được xác định bởi HPLC (và năng suất cô lập tương đối kém chỉ 63%). Các nghiên cứu ban đầu xác định rằng bằng cách thay đổi hỗn hợp bazơ và dung môi từ natri t-amylat và t-amyl alcohol thành natri hydroxit và toluen đã dẫn đến sự cải thiện đáng kể trong cấu hình phản ứng. Để kiểm tra giả thuyết, việc đưa t-amyl alcohol vào đường toluen đã làm xấu đáng kể cấu hình LCMS của các phản ứng với nhiều sản phẩm thủy phân rõ ràng hơn.

Như có thể thấy trong sơ đồ 1, bước cuối cùng này đã được tối ưu hóa để bây giờ thu được tạp chất <13% và có những ưu điểm đáng kể so với phương pháp ban đầu: toluen cho phép nhiệt độ phản ứng cao hơn và thời gian phản ứng và các chất tương đương của rượu giảm đi một nửa.
Trong một công bố khác gần đây, các nhà hóa học tại Sanofi đã tiết lộ quá trình phát triển của Casein Kinase I – chất ức chế Epsilon 3- (3-fluorophenyl) sulfanyl-1H-pyrrolo [3,2-b] pyridine-2-carboxylic axit amide2. Lộ trình khám phá bao gồm một số bước có năng suất trung bình và khả năng tái tạo kém cần phải tối ưu hóa. LCMS được sử dụng để theo dõi các chất trung gian và tạp chất của quá trình hydro hóa / chu trình chính của nitropyridine thành 4-azaindole (như có thể thấy trong Sơ đồ 2 (bên dưới), các tạp chất được công nhận là hydroxylamine và 1-hydroxy-5-azaindoles). Quá trình hydro hóa xúc tác từ thế hệ đầu tiên được thay thế bằng quá trình hydro hóa chuyển giao trên quy mô lớn với độ tinh khiết của nguyên liệu ban đầu là ketoester cũng như nồng độ của amoni formate chứng tỏ chìa khóa thành công.
LCMS cũng đã được sử dụng để theo dõi tiến trình của quá trình phân giải enzym không đối xứng trong nghiên cứu của một nhóm từ Eli Lilly đang xem xét quá trình tổng hợp β-prolines tinh khiết đối xứng3. Ban đầu, quá trình thủy phân của một loạt các este metyl β-proline bằng 13 enzym thủy phân được xác định bằng LCMS achiral (chuyển đổi khoảng 50%) và độ tinh khiết quang học của chúng bằng GC bất đối với lên đến 96% ee được ghi lại. Do đó, phản ứng este hóa ngược được sàng lọc với một loạt lipase từ axit cacboxylic raxemic cho thấy độ chọn lọc thấp ở những lần thử đầu tiên. Sự phát triển của phương pháp LCMS bất đối xứng (sử dụng cột CHIRALPAK AD) đã cho phép phân tách đường cơ sở của bốn thành phần (cả hai chất đối quang của este ban đầu và axit) và cho phép tự động hóa hóa học và phân tích. Sau khi tối ưu hóa toàn bộ quy trình được dẫn dắt bởi dữ liệu LCMS bất đối xứng, quy trình trong Sơ đồ 3 (bên dưới) đã được áp dụng để mang lại cả hai chất đối quang của β-proline được bảo vệ N-Boc ở mức dư thừa đối quang cao.

Trong một ví dụ khác về việc sử dụng LCMS của các nhà hóa học quá trình, sự phát triển của tiền chất epoxit bất đối xứng thành chất đối kháng CCR1 đã được báo cáo bởi AstraZeneca4. Con đường hóa dược ban đầu đến chất trung gian quan trọng này bắt nguồn từ một quá trình epoxy hóa không đối xứng Sharpless, tiếp theo là nosyl hóa và chuyển vị bằng phenol. Chất nosylate trung gian không thích hợp để mở rộng quy mô và hóa học mới được tạo ra để loại bỏ chất trung gian này. Sau nhiều quá trình phát triển, một con đường đi qua một diol được bảo vệ để tạo thành epoxit trong bước cuối cùng đã được chọn với LCMS cũng như ReactIR, gần IR và NMR hỗ trợ quá trình phát triển. Việc sử dụng quy trình nhiệt độ được kiểm soát cẩn thận đã làm giảm đáng kể việc sản xuất các sản phẩm phụ oligomeric của phenoxide và dẫn đến hóa học tương thích đa biểu đồ.
Một quá trình phát triển khác, lần này là trong lĩnh vực hóa trị ung thư, đã được GSK công bố trong việc tổng hợp một lộ trình có thể mở rộng tới GSK923295A5. GSK923295A là chất ức chế chọn lọc hoạt động của enzym vùng vận động CENP-E có chức năng độc quyền trong nguyên phân. Bắt đầu từ phenylalaninol sẵn có, quá trình acyl hóa Friedel-Crafts (tạo ra sản phẩm para) và tạo dẫn xuất thành pyridyl imidazole đã được giả định để tạo ra hợp chất đích. Tuy nhiên, về sự hình thành dị vòng, một sản phẩm phụ mới được xác định bởi LCMS và được xác nhận hoàn toàn bằng tổng hợp de novo. Việc sử dụng TBAB dường như làm tăng đáng kể tốc độ phản ứng nhưng cũng làm phát sinh sản phẩm phụ được brom hóa như trong sơ đồ 5 dưới đây. Thật vậy, tiềm năng brom hóa của imidazole này được tạo ra bởi một phản ứng thử nghiệm trong đó sự chuyển đổi tức thời và định lượng của GSK923295A trung gian thành sản phẩm phụ khi bổ sung NBS đã được nhìn thấy. Khả năng phản ứng của imidazol đối với quá trình brom hóa đã được ghi nhận rõ ràng nhưng nguồn gốc của brom điện hướng trong trường hợp này vẫn chưa được xác định.

Sự tổng hợp của một chất đối kháng thụ thể CRF1 mới, được mô tả gần đây bởi Bristol-Myers Squibb, cũng bao gồm các bước phát triển quy trình do LCMS dẫn đầu. Một trong những chất trung gian quan trọng trong lộ trình tổng hợp này là aminopyrazole được thay thế trong sơ đồ 6 (bên dưới) được chuyển thành pyrazolotriazine.

Khi hình thành aminopyrazole ban đầu, một sản phẩm phụ (lên đến 10%) được xác định bằng phân tích HPLC và LCMS xác định rằng nó có cùng khối lượng với imidate cần thiết cho thấy có đồng phân. Để xác nhận điều này, aminopyrazole được đun nóng trong toluen ở 100 ° C tạo ra hỗn hợp aminopyrazole và đồng phân 90:10. Sự tinh chế sau đó và phân tích NMR đã chỉ định một cách kết luận cấu trúc là sản phẩm di chuyển acyl được tìm thấy tồn tại ở trạng thái cân bằng. Sau một loạt các thí nghiệm sàng lọc trên chất xúc tác axit, người ta thấy rằng axit tosic nên được thay thế bằng axit trifluoroacetic để đạt được quy trình cuối cùng.
Một quy trình dược phẩm khác được hưởng lợi từ việc sử dụng LCMS là sự tổng hợp 2-morpholine bất đối được công bố gần đây xuất hiện trong một số hợp chất có hoạt tính dược lý như reboxetine. Các tạp chất quy trình điển hình được xác định có thể được nhìn thấy trong Sơ đồ 7 – với tạp chất đối quang chính là mối quan tâm chính.
Sau khi sàng lọc dung môi kết tinh lại, việc sử dụng 2-propanol ở nhiệt độ cao được xác định là có tác động đáng kể đến mức tạp chất đối quang. Thật vậy, thử nghiệm giả thuyết này bằng cách đun nóng dung dịch morphin bất đối (với ee> 98%) trong 2-propanol và đo lượng dư đối quang (ee%), người ta thấy sự sụt giảm sau tám giờ (97,5%) và thậm chí hơn nữa sau 24 giờ (80%). Khám phá này đã dẫn đến những cải tiến đáng kể trong năng suất quy trình. Tạp chất quan trọng khác được LCMS xác định trong một số lô morphin bất đối xứng là một isobutyl xeton và đã được phê chuẩn bằng cách tổng hợp độc lập. Sau một số thí nghiệm thử nghiệm để xác định nguyên nhân của tạp chất này, nó dường như là do việc sử dụng DIBAL làm chất khơi mào trong phản ứng Grignard để tạo ra morphin bất đối xứng.
Kết luận
Như có thể thấy trong các ví dụ chính trong vài năm qua, LCMS trong phát triển quy trình dược phẩm đang nhanh chóng trở thành một kỹ thuật thiết yếu. Khả năng xác định các ponents của hỗn hợp phản ứng quy trình đã dẫn đến những cải thiện đáng kể về sản lượng, cấu hình tạp chất và sự quay vòng của lò phản ứng và được thiết lập để trở thành trụ cột chính trong các tổ chức dược phẩm.
Nguyên lý hoạt động máy đo độ hòa tan trong Dược Phẩm
Máy đồng hóa mẫu sử dụng trong sinh học phân tử
Kính hiển vi điện tử quét: Công cụ cho khoa học và kinh doanh